Microscopie 3D à balayage laser multiphotonique combinant une imagerie confocale à deux photons à haute sensibilitée avec des modalités d’imagerie quantitative telles le FLIM (Fluorescence Lifetime Imaging Microscopy) et la F(C)CS (Fluorescence (Cross)-Correlation Spectroscopy).
Contact: quest-piq@unistra.fr
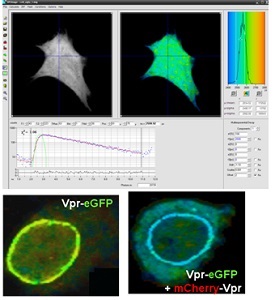
Microscopie d’Imagerie en Temps de Vie de Fluorescence (FLIM)
Le FLIM est une technique consistant à mesurer les temps de vie de fluorescence d’un fluorophore pour chaque pixel de l’image. Ils ne sont alors plus détectés selon leurs longueurs d’ondes d’émission mais seulement selon leur temps de vie. En utilisant le principe du Transfert Résonnant d’Energie de Fluorescence (FRET), les interactions protéine-protéine (l’une marquée par un donneur d’énergie de fluorescence et l’autre par un accepteur) peuvent être résolues spatialement en mesurant le temps de vie de fluorescence du donneur. Le principal avantage de cette technique découle du fait que le temps de vie de fluorescence est un paramètre intrinsèque qui ne dépend pas de la concentration en donneur et de la puissance d’excitation du laser.
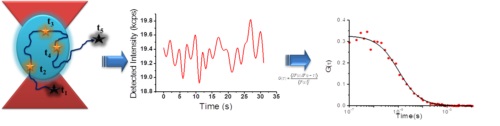
Spectroscopie par Corrélation de Fluorescence (FCS)
La FCS est une technique basée sur l’analyse des fluctuations d’intensité d’espèces fluorescentes diffusant à l’intérieur d’un volume de l’ordre du femtolitre (défini par le laser d’excitation). La constante de diffusion, la concentration locale et la brillance de chacune de ces espèces, étant reliées à leurs propriétés photophysiques et hydrodynamiques, peuvent ainsi être déterminées.
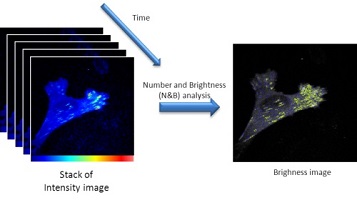
FCS à balayage (sFCS)
En sFCS, le signal de fluorescence est collecté en balayant le faisceau laser sur l’échantillon. Dans ce cas, les fluctuations de fluorescence contiennent à la fois des informations spatiales et temporelles sur les espèces fluorescentes. Différents modes de sFCS sont disponibles selon les paramètres requis (FCS circulaire, RICS, N&B). Les techniques de sFCS sont particulièrement adaptées pour des espèces à diffusion lente.
Caractéristiques techniques
Modes d’acquisition
- FLIM-FRET
- F(C)CS
- Microscopie confocale 3D multiphotonique
- HomoFRET
- FCS à deux foyers
- FCS à balayage sFCS
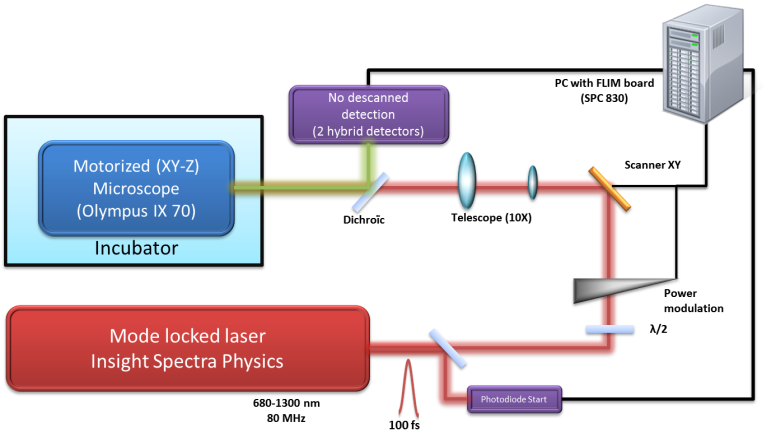
Statif
- Statif Olympus IX83
- Platine XY motorisée Marhauzer
- Automatisme (shutter, scanner XYZ, modulateur de puissance, …) piloté par Labview
Détection
- 2 sAPD en détection déscannée (Perkin Elmer SPCM-14)
Système d’acquisition
- Carte d’acquisition SPC 830 (Becker Hickl) pour le FLIM
- Carte PCI 6602 (National Instrument) pour l’imagerie 2D/3D, sFCS
- Autocorrélateur ALV 5000 (ALV Gbmh) pour la FCS et FCCS
Le système est piloté à l’aide d’une interface Labview développée au laboratoire et l’analyse des données est réalisée au moyen de différents outils (SPC Image, QuickFit, FijI) et d’outils développés au sein du laboratoire à partir de différentes plateformes (Labview, Matlab, IgorPro, Origin)
Laser
- Laser femtoseconde Insight Spectra-Physics (680 nm/1300nm) pour la génération d’une excitation biphotonique avec pré-compensation.
Inserts- porte objet
- Insert universel (Lames, Labtek, boites de ø 30mm, etc.)
- Insert pour plaque (boites multipuits)
Accessoires
- Enceinte à température régulée (PECON)
- Table optique (Thorlabs)
Objectifs
| Mag. | N.A. | Quality | Imm. | WD | Ref |
| 60x | 1.2 | IR optimized | Water | 0.28 | UPLSAPO 60XW |
| 20x | 0.3 | / | Dry | 2.0 |
N’oubliez pas de citer la plateforme dans les remerciements